Assim como vimos no modelo de Rutherford-Bohr (apesar de não ser a representação correta), o átomo possui níveis energéticos. Os elétrons distribuem-se nesses níveis respeitando os subníveis de energia, que são representados pelas letras s,p, d e f. E qual é o significado de cada uma dessas letrinhas?
S- sharp
O subnível s suporta até dois elétrons.
P- principal
O subnível p suporta até seis elétrons.
D- diffuse
O subnível d suporta até dez elétrons.
F- fundamental
O subnível f suporta até catorze elétrons.
Para facilitar a distribuição dos elétrons em cada átomo, Linus Pauling criou o Diagrama de Linus Pauling, ou diagrama dos níveis energéticos, que é representado assim:
Como podemos ver, a distribuição dos elétrons sempre será de forma crescente, ou seja, do menor nível para o maior.
Exemplos:
S- sharp
O subnível s suporta até dois elétrons.
P- principal
O subnível p suporta até seis elétrons.
D- diffuse
O subnível d suporta até dez elétrons.
F- fundamental
O subnível f suporta até catorze elétrons.
Para facilitar a distribuição dos elétrons em cada átomo, Linus Pauling criou o Diagrama de Linus Pauling, ou diagrama dos níveis energéticos, que é representado assim:
 |
| https://s3-sa-east-1.amazonaws.com/manual-do-enem-test/7dd9b09d2c5d4195bf5f9ad2de472f1b-Imagem1.png |
Por conta disso, é importantíssimo saber quantos elétrons cada nível energético suporta. Podemos analisar pela seguinte imagem:
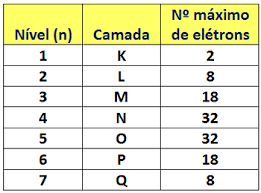 |
| http://www.tabelaperiodicacompleta.com/wp-content/uploads/2013/06/niveis-energeticos.png |
Be (Berílio, número atômico = 4) = 1s2 2s2
Ca (Cálcio, número atômico = 20) = 1s2 2s2 2p6 3s2 3p6 4s2
Fe (Ferro, número atômico = 26) = 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Vale ressaltar que a distribuição eletrônica muda se o átomo ganha ou perde elétrons, ou seja, muda quando ele vira um íon.
Então, caro leitor, essa foi a postagem sobre distribuição eletrônica. Obrigada pela atenção!
Comentários
Postar um comentário